こんにちは!ポケット予備校です!
今回の記事から、東大化学の過去問の解答、解説です!できるだけ、どのように考えながら進めれば良いかに重点を置いています。
今回の記事では、2018年の東大化学の解答、解説と、全体を振り返ってみたいと思います。
問題はこちらから
全体の概観
前年2017年が近年最も簡単と言われていて、それの反動がきたというか、問題量、難易度ともに、前年よりは厳しいものになったいたと思われます。なかなか厳しいセットですが、大問3の計算に時間を割きすぎずに、取れるところを取る姿勢がかなり活きる構成だったと思います。
大問1はアミノ酸で、最近東大も出題し始めた分野のためか、それほど応用されたものではありませんでした。しかし、アミノ酸の反応や検出に関しては全ての知識を問われている印象が持てる問題で、少しの抜けも許されないです。
大問2は錯体に関する知識がないと厳しい設問がありますが、そこを除けば解き切ることができないといけない問題です。
大問3は東大らしさが出ている問題とは個人的に感じていて、後半は1つのテーマに縛られず、理論の総合的な設問になっています。前半は多くの受験生が苦手な緩衝溶液で、差がつくと思われます。
大問1

難易度
例年通り
概観
東大の有機化学の問題としては、それほど難しくないのではないかと考えられます。問題全体のテーマとしては、アミノ酸の特徴をしっかり理解した上での、構造決定です。アミノ酸の知識としては、そこまで高い内容は求められていませんが、少し時間がかかるとは思います。
構造決定の段階で、かなり悩むというところはないと思うので、いかにテキパキ進めることができるかということが問われています。
オの問題はそのものを除くということを忘れている答案もおそらく散見されるでしょう。
解答・解説
有機の問題では、手順がたくさんあるので、全体を見通してから各設問に入りたいと思います。
実験1 Bは同じアミノ酸から構成されていて、A、C、Dは異なるアミノ酸から構成されています。
実験2 黒色沈殿は硫化鉛であり、A、Cは硫黄を含むことが分かる。よって、AとCには①、⑥のいずれかが含まれる。
実験3 この反応はキサントプロテイン反応であり、A、Bはベンゼン環を含むことが分かる。よって、AとBには④、⑤のいずれかが含まれる。
実験4 塩化鉄(Ⅲ)水溶液を紫に呈色するのは、フェノール性水酸基を含む時であり、Bには④が含まれる。
実験5 Aには硫黄が含まれていることが分かる。二量体を形成するときは、硫黄原子が末端にある方が効率がいいと判断できるので、Aには①が含まれると分かる。
実験9 Dは中性条件下で移動しないので、中性状態である。Fは塩基性条件下、中性条件下でも、移動しないので、酸性状態である。FとDで状態が変わっていることから、塩基性アミノ酸があり、無水酢酸で反応してその部分の機能がなくなったと考えることができる。よって、Dは酸性と塩基性から、打ち消しあって中性に、Fは塩基性がないので、酸性になったと考えることができる。
ア 2C2H5OH+2Na→2C2H5O Na+H2
アルコール類にナトリウム単体を入れると、水素が発生します。これを踏まえて式を立てましょう。
イ ①、⑥
上の考察より、①、⑥
ウ ④
上の考察より、④
エ a ジスルフィド b還元
硫黄→二量体は、ジスルフィド結合しかないでしょう。過酸化水素水が酸化剤として働いているので、逆の反応であることから、還元剤とすることが望ましいでしょう。
オ Aの立体異性体:3 Bの立体異性体:2
まず、それぞれの構造決定を行いましょう。Aは、実験5より、①が含まれている。また、実験4より、Aには④が含まれていない、実験3と合わせて、Aには⑤が含まれる。次に、Bは、実験4より、④が含まれていて、実験1と合わせて、④が2つ含まれる。
以上から、Aは①、⑤、Bは④から構成される。異性体の個数を数え上げるときは、不斉炭素原子の個数に注目する。AもBも、2個なので、22=4個のはずだが、A、Bそのものは除くとあるので、Aに関しては4−1=3、Bに関しては、同じアミノ酸から構成されるので、4−1−1=2となる。
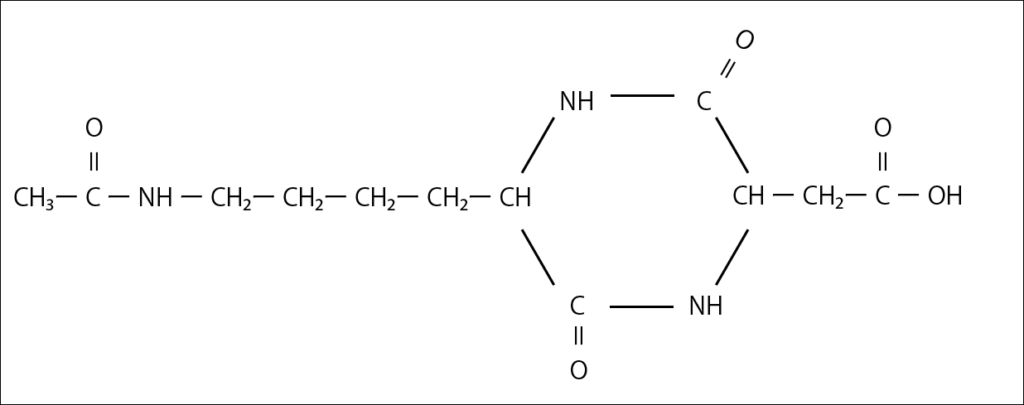
カ 以下の図のようになる。
Bのアミノ酸部分に注目すると、④でベンゼン環にヒドロキシ基があり、ヒドロキシ基はオルト、パラ配位であることを考慮する。

キ 5:9
有機物を燃焼させた時生じる二酸化炭素は、有機物のC由来、水は、有機物のH由来となる。よって、有機物のCとHの比は、66.0×10−3×12/44:24.3×10−3×2/18=5:9と分かる。
ク ⑥、⑦
実験2、5より、⑥が含まれる。キを参考にすると、CとHの個数を計算して、⑦と分かる。
ケ ③、⑧ 理由:Dの中には、カルボキシ基とアミノ基が1個ずつあるため、中性条件下では、Dは双性イオンとなっているから。
実験9から、酸性アミノ酸と塩基性アミノ酸を選べば良いので、③、⑧を含む。
コ 以下の図のようになる。
Dで、⑧のアミノ基と、無水酢酸が反応させれば良い。
大問2
難易度
やや易
概観
無機化学の問題です。無機化学は多量な知識が要求されることが多いですが、東大はそこまで深い知識は要求されないということが顕著に表れているのではないでしょうか。
ア、ウ、オ、クあたりは、基礎的な問題ですので、ぜひ得点したい問題です。
イ、エ、ケあたりの問題は、計算が少し面倒ではありますが、問題レベルとしてはそこまで高くないと思われます。
カ、キはそれぞれ、錯体に関して知っていないと厳しい問題だとは思いますが、合格点を目指すには、できれば1つでもいいので、取りたい問題だと思います。
解答・解説
ア Ca(OH)2+CO2→CaCO3+H2O
CaCO3→CaO+CO2
消石灰に二酸化炭素を吹きこむと、炭酸カルシウムが生じます。炭酸カルシウムが生じることさえ、分かれば、係数を合わせます。
イ 0.48nm
まず、酸素イオンの原子半径を求めます。マグネシウムイオン(A)と酸素イオン(B)は接しているので、結晶格子の1辺に注目すると、2(A+B)=0.42nmとなる。表2-1より、A=0.086から、B=0,124と分かる。表2-1から、カルシウムイオンの半径C=0.114であるから、求める答えは、2(B+C)=2(0.114+0.124)=0.476nmとなる。
ウ MgO 理由:陽イオンは全て2価であるが、イオン半径を考えると、Mg2+が最も小さいため、陽イオンと陰イオンの中心間距離が最も小さく、クーロン力が最も強く働くから。
物質の融点や沸点を考える時は、結合の強さに注目します。ここでは、陰イオンと陽イオンなので、クーロン力を考えます。クーロン力の強さは、イオンの価数とイオン半径に依存します。ここでは、価数が同じなので、イオン半径を考慮します。
エ 1.3
まず、アルミニウムを酸化して、酸化アルミニウムに変化する化学反応式を考えます。4Al +3O2→2Al2O3となる。この式から、アルミニウム4molから、酸化アルミニウムが2mol生じることが分かり、質量で考えると、アルミニウム4×27=108gから、酸化アルミニウム2×(54+48)=204gが生じることになる。それぞれの密度は表に記載されてある通りなので、アルミニウムの体積は108÷2.70=40cm3。酸化アルミニウムの体積は204÷3.99=51.12‥cm3となる。よって答えが求められる。
オ アルミニウムのイオン化傾向が非常に大きいので、水の還元が優先的に起きるから。
金属イオン→金属単体、金属単体→金属イオンの変化は起こるのかどうかを見たい時は、イオン化傾向に注目します。アルミニウムイオンを含む水溶液中では、アルミニウムのイオン化傾向が大きいために、アルミニウムはイオンのまま存在して、単体として析出させることが難しくなっています
カ Al2O3・3H2O+2NaOH→2Na[Al(OH)4]
バイヤー法に関連する化学反応式を書く問題です。これに関しては覚えるしかありません。無機化学の金属イオンの問題では、錯イオンが出てくることが多いので、注意してください。
キ 以下の図のようになる。
問題文に従うと、n=2、m=4となる。与えられた錯イオンは、アルミニウムを中心として、周囲に水分子が4つ、水酸化物イオンが2つ配置されることになります。つまり、6個の頂点を有する立体図形は?ということを考えます。よって、正八面体になります。これは錯イオンの分野では基本的な知識になると思うので、覚えておくことが必要でしょう。あとは、回転させても同じ形にならないような正八面体を探します。

ク C+O2−→CO+2e−
C+2O2−→CO2+4e−
陽極では酸化が起きるということを覚えましょう。あとは、左辺には炭素単体、右辺には炭素と酸素の化合物があり、左辺は酸素原子が不足しています。そして、それに合わせて、電子を右辺に追加します。
ケ 1.76×102kg
クの式に加えて、陰極での反応式も考えます。
Al3++3e –→Alとなります。アルミニウムが180kg生じたということなので、180000÷27=6.67×103molとなり、係数を比較して、電子は2.00×104mol反応に関わっています。また消費された炭素原子は、720000÷12=6.00×104molです。生じたCO、CO2の物質量をそれぞれ、x、yと置くと、陽極での化学反応式から、炭素原子は(x+y) mol、電子は(2x+4y)molとなる。ゆえに、x+y=6.00×104、2x+4y=2.00×104を解きます。よって、答えが導かれます。
大問3
難易度
やや難
概観
理論化学の問題です。前半で、緩衝溶液の問題、後半は総合的な問題になっています。緩衝溶液の問題としては、応用問題というわけではないですが、緩衝溶液の問題が出たというだけで、受験生は苦手な人も多いので、点数差がつくと思います。ア、イ、ウあたりまで解けたら合格点でしょう。緩衝溶液の問題が難しい分、後半は比較的簡単な問題になっています。コのみ、計算に時間がかかるとは思いますが、それ以外は時間をかけずに終わらせる必要があります。大問としては、バランスの取れた難易度になっていると思われます。
解答・解説
ア 5.0×10−2mol/L
物質量を求めるために、気体の状態方程式を利用します。
NH3の物質量は、1.0×105×0.20×40/8.3×103×300=3.21×10−1となる。塩酸にアンモニアが溶かされているので、混合溶液中では、塩酸と塩化アンモニウムが共存している。ここでは、アンモニアを溶かしても、溶液の体積変化は無視できるということに注意すると、
[H+]=9.0×10−2―8.03×10−2/2.0=4.98×10−2
イ 5.6×10−10mol/L
Kaを求めるのですが、KbとKwを利用します。Ka=[NH3][H+]/[NH4+]、Kw=[H+][OH−]=1.0×10−14、Kb=[NH4+][OH−]/[NH3]=1.8×10−5から、KaKb=Kwとなり、求める値は、1.0×10−14/1.8×10−5=5.6×10−10となる。
ウ 7.1×10−10mol/L
この問題はアンモニアの溶かされた量が、塩酸の元の物質量を超過していることから、緩衝溶液であることに注意する必要がある。[NH4+]=9.0×10−2、[NH3]=3.21×10−1−1.8×10−1/2.0=7.05×10−2とわかる。
よって、[H+]=Ka×[NH4+]/[NH3]=1.0×10−14/1.8×10−5 × 9.0×10−2/7.05×10−2=7.09×10−10となる。
エ (4)
緩衝溶液について理解しておく必要がある。この問題のように、pHの変化が問われることはとても多いので、要注意です。この実験下であると、塩酸とアンモニアの反応が終了する前後で大きくpHが変化する。その後、アンモニア過多となり、アンモニアと塩化アンモニウムの緩衝溶液となり、ここでは弱塩基性であり、名前の通り、pHの変化は小さい。40分以降、水酸化ナトリウム水溶液を加えると、塩化アンモニウムと水酸化ナトリウム水溶液の反応が終了する前後で大きくpHが変化する。その後、水酸化ナトリウム水溶液が過多となり、水酸化ナトリウム水溶液と塩化アンモニウム水溶液の緩衝溶液となり、ここでは強塩基性であって、pHの変化は小さい。以上をまとめる。
オ 1.2
アンモニアは弱塩基遊離によって、塩化アンモニウムになっても、元に戻ることは注意しましょう。混合後は、1.8×10−1molの NaCl3.21×10−1molの NH3 (4.0×10−1−1.8×10−1=)2.2×10−1molのNaOHを含む水溶液となる。
ここに、ある量の塩化アンモニウムを加えた時、水素イオン濃度が40分後の場合より、大きくなっているので、水酸化ナトリウムは全て反応したと考えることができる。ゆえに、NH4Clの物質量をaとおくと、溶解後のNH4Clは、a−2.2×10−1mol、NH3は(3.21×10−1+2.2×10−1=)5.41×10−1molとなる。よって、[NH3]/[ NH4+]=5.41×10−1/a−2.2×10−1であり、Ka=[H+][NH3]/[NH4+]に各値を代入して、aについて解きます。
カ 以下の図のようになる。
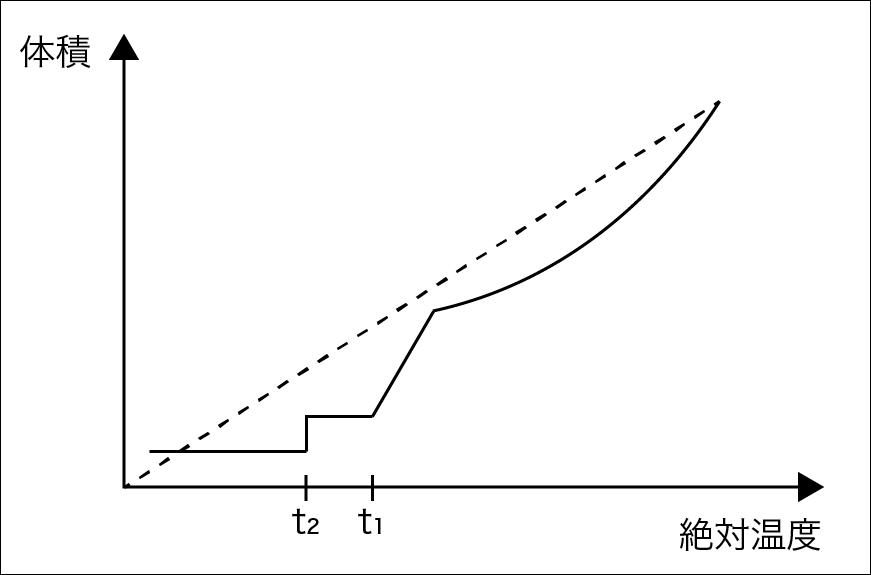
T1で気体から液体に、T2で液体から固体に変化するということは文章中に書かれてあるので、読み取りましょう。体積の大きさは気体>>液体>固体であるため、T1で極端に、体積が小さくなることを描き、T2では小さくはなるものの、T1での減少量よりは小さいというこ風に描くことができれば良いでしょう
キ CH4+H2O→CO+3H2
文章中に、メタンと水蒸気(H2O)から、一酸化炭素と、水素が生じる反応とあるので、これに従い、係数を合わせましょう。
ク 高圧にすると、ルシャトリエの原理より、気体の合計分子数が減少する右に移動し、さらに、圧力が高いほど、反応速度が大きくなるから。
可逆反応において、反応の速さや、進みやすさを議論するときは、ルシャトリエの原理を考えます。気体分子の係数和を確認すると、左辺は3、右辺は1となります。ルシャトリエの原理では、高圧の時、係数和が小さい方向に反応が進むというのがあったので、左辺いより反応を進めるときは高圧にする必要があります。また、ここでは反応速度も考慮することが可能です。反応速度が大きくなるのは、高温高圧、濃度が大きい時です。よって、高圧にすれば、反応速度が大きくなるとうことも書ければ、より良いでしょう
ケ 一酸化炭素 0.32mol、メタノール 1.24mol
反応前と反応後の、水素の物質量の変化量に注目しましょう。2.72−0.24=2.48 molの水素が消費されています。式1の係数に注目すると、一酸化炭素は2.48÷2=1.24mol消費され、メタノールは1.24mol生じます。
コ Q=92kJ
与えられたものに、二酸化炭素、燃焼熱があることがポイントです。
CO(気)+2H2(気)=CH3OH(気)+Q ‥①
CH3OH(液)=CH3OH(気)―38kJ ‥②
CH3OH(液)+3/2O2(気)=CO2(気)+2H2O(液)+726kJ ‥③
生成熱が与えられているので、反応熱=(生成物の生成熱の総和)―(反応物の生成熱の総和)の関係を使えるように変形を行う。
①―②+③より、
CO(気)+2H2(気)+3/2O2(気)=CO2(気)+2H2O(液)+(Q+764)
Q+764=(394+286×2)―110を解く。

東大理系、2019年の入学で、ポケット予備校では化学を担当しています!この記事がみなさんの参考になることを願っています!
